作者:张欣 (中国科学院合肥物质科学研究院)
本文选自《物理》2020年第6期
摘要
将磁场作为一种干预手段应用于医疗健康领域,俗称“磁疗”,在过去的几千年人类历史中曾有过多次的争论与起伏。由于结果不一和机制不清等多方面原因,“磁疗”目前作为一个整体还未被广泛接受。然而,近年来不仅有利用脉冲磁场的经颅磁刺激被批准应用于临床,并且有越来越多的实验证据显示,基于稳态磁场的健康干预也有着良好的应用前景。文章主要围绕稳态磁场对血流、骨骼和疼痛三方面的影响,总结其研究现状并分析其局限与困境,期待不同学科背景的研究者能够涉足此领域,进行更规范化、系统化的深入研究,在明确其机制的前提下对磁场参数进行优化,从而可以早日科学地、有效地将稳态磁场作为一种干预或辅助手段应用于医疗健康领域。
关键词 稳态磁场,磁疗,血流,骨骼,疼痛
稳态磁场也称静磁场或稳恒磁场,指的是强度和方向不随时间而变化的磁场。尽管关于磁场的强度划分在不同的学科领域有所不同,也会随着磁性材料和超导等技术的进一步发展而有所变化,但是目前在生命健康领域,人们一般把低于1 mT 的磁场称为弱磁场,1 mT—1 T 为中等磁场,1 T以上为强磁场,5 T或者20 T以上称为超强磁场。例如,对于一般常见的非特殊拼接的磁铁,其表磁强度都在中等磁场范围内。而在医疗领域广为应用的磁共振成像(MRI)中的主体部分就是一个强稳态磁场,目前大多数医院里所用的MRI 为0.5—3 T。由于场强的升高直接有助于提高成像分辨率,近年来7 T 的MRI 已批准应用于临床,9.4 T的MRI也进行了一些前期的人体临床试验。
除了利用磁场进行MRI检测以外,近年来随着物理、工程、生命和医学各领域技术的发展,人们开始利用各种不同的技术手段从多个角度来研究磁场对于生物体的作用,不仅对磁场作用于人体的效应有了一定的了解,也初步开发了磁场在促进人类健康中的应用。例如,经颅磁刺激(TMS),即利用脉冲磁场靶向性无创作用于中枢神经,已被FDA批准用于治疗多种疾病,包括抑郁症、偏头痛、脑或脊髓损伤引起的中枢性疼痛、疱疹后神经痛、纤维肌痛和面神经性疼痛等[1—3]。在我国,2009 年武汉依瑞德公司生产的TMS设备获得了SFDA 注册证。2012 年,中国医学科学院生物医学工程研究所殷涛团队联合制定了《磁刺激设备》国家医药行业标准。此外,磁外科,即将磁场应用于多种外科手术,例如利用磁体间的吸力来进行组织挤压,从而无需缝线,避免了“针孔效应”带来的吻合口漏以及吻合口水肿、愈合缓慢等不良反应。在西安交通大学第一附属医院吕毅团队为代表的医生们的共同努力下,在肝移植、肠道修复等多种手术中显示出了明显的优势[4]。
相比之下,关于将稳态磁场作为一种干预手段来应用于医疗健康领域,即某种意义上的“磁疗”,虽然有着悠久的历史,但一直存在着争议。在过去的几十年间也有为数不少的相关研究[5,6],但由于结果不一和机制不明等原因,导致其目前还没有被主流医学所广泛认可。之前在本刊,我们介绍了稳态磁场对肿瘤影响的研究进展[7]。在本文中,我选取了到目前为止稳态磁场在生命健康领域实验证据相对较多的三个方面进行总结和展望,即血流、骨骼和疼痛,也是未来将稳态磁场推向医疗健康领域极有潜力的三个方面。
01 稳态磁场与血流
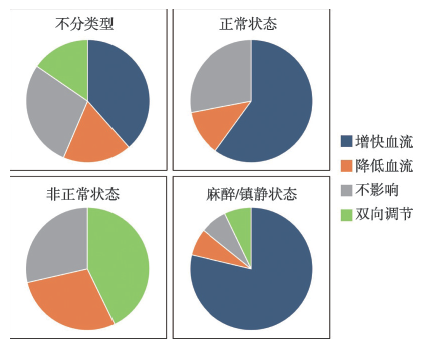
血液流动涉及到氧和营养物质的供应以及机体代谢,与人体的多种生理病理状态密切相关。磁场与血液流动的关系也是人们密切关注的焦点。事实上,经过文献查找,我们发现了至少有39 篇关于稳态磁场与血流的研究报道。然而,它们的结果并不一致,甚至存在一些看似矛盾的结果,这与2007 年的一篇综述结论类似[8]。但是,我们发现一个有趣的现象,就是在这39 篇稳态磁场与血流相关文献中,有15 篇(38.5%)报道了稳态磁场可以增加血流(其中大部分都是麻醉/镇静动物模型,只有4 篇为非麻醉/镇静状态),有7 篇(17.9%)报道了稳态磁场可以降低血流(1 篇是麻醉/镇静动物模型,6 篇为非麻醉/镇静状态,而且降低的大多是疾病状态血流,例如肿瘤中的血流),11 篇(28.2%)显示稳态磁场对血流无影响,还有6篇(15.4%)显示稳态磁场对血流的影响呈现双向性。而对于正常(非疾病或者药物诱导状态)的人和动物研究共有25 篇,其中15 篇(60%)升血流(其中大部分都是麻醉/镇静动物模型,只有4 篇为非麻醉/镇静状态);3 篇(12%)降血流(1 篇是麻醉/镇静动物模型, 2 篇为非麻醉/镇静状态);7 篇(28%)无影响。对于疾病、药物诱导或其他非正常状态的人和动物研究共有14 篇:其中6 篇(42.9%)显示双向调节性;4 篇(28.6%)降血流(1 篇是麻醉/镇静动物模型,2 篇为非麻醉/镇静状态);4 篇(28.6%)无影响。而对于14 篇麻醉/镇静状态下的动物研究发现,11 篇都显示了增快血流的效果,其余3 篇分别显示降低血流、双向调节或是无影响(图1)。
多篇文献报道都显示稳态磁场可以调节机体的血液流动。例如,2001 年Okano和Ohkubo研究局部施加1 mT稳态磁场30 分钟对清醒兔耳垂中央动脉的血流动力学影响,发现磁场在N-硝基-L-精氨酸甲酯诱导高血压和血管收缩情况下可显著减弱血管收缩(血液流动增加)并抑制血压升高,在尼卡地平诱导降血压和舒张血管情况下可显著降低血管舒张,增强血管收缩(血液流动减少),拮抗血压降低,而单独磁场暴露无明显变化[9]。稳态磁场单独处理缺乏明显反应可能是由于正常生理状态未加药物治疗的血管处于平均张力或者多条血管的双相反应抵消了血液流动的任何净变化。Morris 和Skalak 在大鼠中同样发现70 mT 稳态磁场局部暴露15 分钟对大鼠骨骼肌微血管张力有恢复作用,即初始状态为血管扩张的较小直径血管经磁场处理后血管张力显著增加,初始状态为血管收缩的较小直径血管的张力显著减少[10]。此外,Kim等人则在14 名健康受试者的右脑额颞叶分别放置了0.3 T永久静磁铁,发现右额顶叶和右岛叶的脑血流明显增加,左侧额叶和左侧顶叶区域脑血流明显降低[11]。
造成文献报道结果不一致的可能原因是多方面的。例如,在研究稳态磁场暴露对微循环和微血管系统的作用效应时,有些动物实验是在麻醉状态下进行,而麻醉药物可以影响神经,甚至可能影响血液流动[12—13]。另外,一些研究测量磁场处理间的血流,一些研究测量磁场处理后的血流,还有一些测量在这两个时期的血流,但是磁场处理期间和处理后观察到的作用效应可能不同。如Ichioka(1998 年)等人发现麻醉大鼠暴露于8 T 稳态磁场后1—5 分钟皮肤微血管血流明显增加[14];之后他们进一步研究发现,8 T稳态磁场作用于麻醉大鼠全身期间皮肤血流量降低,而从磁体中撤离后恢复正常,这可能是由于磁场暴露期间血流量减少所引起的补偿性充血[15]。此外,还有很多因素也会使情况更加复杂化,比如处理时间、作用对象和磁场梯度等变量。这些相互冲突或包容性的研究结果往往削弱了发现的有益效果并导致结论不确定。因此,我们需要仔细设计并记录实验细节,从而在理论上增加研究的独立可重复性并且更全面地了解这一研究领域。
研究者们也对稳态磁场影响血液流动的可能机制进行了描述和推测。例如,Tzirtzilakis 提出了一个适用于描述外加磁场作用下牛顿流体流动的生物磁流体动力学数学模型。该模型采取了铁流体力学和磁流体力学的原理,同时考虑了血液的磁化强度和电导率。其结果显示磁场强度和梯度都与其影响血流的效果有关[16];还有多项研究从磁流体力学的角度计算了磁场对血流的可能影响,例如,2017 年,Rashidi 从磁流体力学的角度总结和分析了磁场对血流以及血栓形成等的影响的可能机制及医学应用[17];然而,从生物医学的角度而言,仅从流体力学等方面并不能够完全解释生物体作为一个复杂的整体在磁场下的响应。例如,研究发现稳态磁场可能通过调节交感神经活动来抑制交感激动剂引起的血流动力学的变化[18]。也有研究表明磁场可能影响一氧化氮、压力反射敏感性和Ca2+信号等途径诱导作用效应[19,20]。因此,目前磁场作用于体内血液流动在各方面虽有了很多研究,但其机制尚不完全确定,需要进一步深入研究。
总体而言,尽管关于稳态磁场与血液流动的实验数据和理论解释仍然没有确切结论,但多项研究表明稳态磁场似乎可以维持循环系统的平衡和“正常化”血管功能,这提示稳态磁场有可能成为一种有效替代或补充手段以应用于血流过多或不足等相关疾病状态的改善。对此,人们还需要进行更多更深入的探索研究,为未来临床试验的严格进行奠定基础,例如区分不同部位和不同类型的血管,以及不同疾病状态和起始状态下的血流变化及其机制等。
02 稳态磁场与骨骼
近年来已有多种基于脉冲电磁场的医疗仪器用于骨质疏松和骨折等的辅助治疗。相比之下,虽然目前还没有稳态磁场相关的医疗仪器,但已有大量的相关研究显示,稳态磁场在防治骨质疏松、促进骨折愈合和骨缺损修复、治疗骨关节炎等方面有着良好的效果和应用前景。西北工业大学的商澎课题组多年来对此有系统性研究,其最近发表的一篇综述也进行了全面分析[21]。从机制上讲,磁场作用于骨组织与其对骨组织细胞增殖及分化的调节相关。在体外,静磁场可促进骨髓间充质干细胞及成骨细胞的分化和矿化,而抑制骨髓单核细胞及破骨细胞的分化和骨吸收活力。静磁场对骨组织细胞调控的可能机制是静磁场影响了细胞生长因子、信号分子、细胞骨架、细胞膜、细胞内钙离子及铁代谢[21]。这些能够从很大程度上解释磁场对骨骼系统的多种作用。
首先,多项实验证据表明稳态磁场可以改善骨质疏松,包括绝经和糖尿病引起的骨质疏松,以及缺血性骨质疏松等。通过局部或者全身稳态磁场处理,实验动物的骨质疏松有所改善。例如,在去卵巢大鼠的腰椎右侧植入一个磁感应强度为180 mT的磁性材料,6 周后发现在靠近磁性材料的大鼠腰椎骨的骨密度显著升高[22]。将去卵巢大鼠全身暴露于30—200 mT的静磁场中12 周,发现其骨密度及骨面积均显著高于未曝磁组[23]。将药物诱导的I 型糖尿病大鼠暴露于4 mT静磁场中16 周,发现静磁场可以抑制糖尿病大鼠的小梁骨和皮质骨的结构损伤及骨力学性能的降低[24]。
其次,实验证据表明静磁场可以促进骨折愈合和骨缺损修复。例如,对杂交犬进行桡骨中段截骨术,两天后在手术部位包裹一圈0.1 T 磁片,8 周后发现磁场显著促进了骨折愈合[25]。我国学者早期也有多例利用磁片研究静磁场对家兔骨折愈合的影响,结果均表明一定强度的静磁场可促进骨折部位钙沉积、缩短骨折愈合时间。研究显示静磁场暴露能够有效提高骨缺损处的骨生成、增强植入物与周围骨质的结合来促进骨缺损的修复。
此外,也有证据表明稳态磁场可能会缓解骨关节炎。例如,人们对狗进行右侧膝关节前交叉韧带闭合切除造成骨关节炎模型,利用无磁性和有磁性的陶瓷片覆盖狗窝的地板,在第68 周检查发现磁场组滑膜炎、滑膜积液、软骨表面的破坏和软骨溃疡的发生率比非磁场处理组要少,表明暴露于磁场的犬骨关节炎的发展受到了抑制[26]。Taniguchi 等人为了研究稳态磁场对大鼠佐剂性关节炎的镇痛作用,对60 只雌性SD 大鼠进行为期12 周的实验,发现稳态磁场处理组的佐剂性关节炎的大鼠尾部表面温度、运动活性和股骨骨密度均显著高于非磁场处理组,其血清炎症标志物也明显低于非磁场处理组[27]。Morris 等人在组胺引起大鼠后肢水肿后立即用稳态磁场持续刺激15 或30 分钟,发现10 mT和70 mT静磁场可使水肿形成减少20%—50%[28]。但是由于目前关于稳态磁场与骨关节炎的文献还不够充足,因此还需进行更多的研究。
03 稳态磁场与疼痛
疼痛的原因和类型多种多样,且影响的人群极为广泛,因此不可能用单一的方法来治疗不同的个体。此外,阿片类药物已被用于治疗包括晚期癌症患者在内的严重慢性疼痛,但关于其副作用的报告日益增加。因此,寻求更安全、更有效的减轻疼痛的方法是医生和科学家的共同目标。
磁铁可以很容易地应用和移除,将疼痛部位局部暴露于磁场而不影响其他部位,因此被许多人用来减轻疼痛。然而,它们是否有效一直都有争议。为了进一步明确稳态磁场对疼痛的影响,我们进行了系统文献调研,对截止到目前为止的设有适当的假曝磁对照组的相关文献报道进行了综合分析。我们共收集到29 篇文献,发现65%的人体研究(23 篇)和100%的小鼠研究(6 篇)都显示了稳态磁场的缓解疼痛作用。首先,在收集到的23 篇稳态磁场对疼痛影响的人体研究中,有15 项显示了稳态磁场确实对人体有明显的镇痛作用。例如,1997 年,Vallbona 等人进行了一项双盲试点研究,以测量脊髓灰质炎综合症患者的肌肉和关节炎疼痛患者对稳态磁场的疼痛反应。他们发现,76%的患者在用0.03—0.05 T的稳态磁场治疗45分钟后疼痛得到改善[29]。2011 年,Kovacs-Balint 等人发现,最大为330 mT的非均匀稳态磁场可显著提高热痛阈值[30]。2012 年,Laszlo 等人发现0—192 mT磁性设备5分钟就可以有效地将颞下颌关节紊乱病组患者的口腔疼痛评分从2.0 降低到0.5,但肺泡炎或口疮组未见明显效果[31]。这些都显示了稳态磁场对疼痛有缓解作用。然而,我们发现也有一些报道没有观察到这种作用。例如,1997 年,Caselli 等人为足跟疼痛患者提供了10 高斯磁鞋垫,治疗4 周后,他们发现治疗组和对照组的疼痛都有所改善( 分别为58% 和60%), 但两者之间没有显著差异[32]。2000 年,Collacott 等人使用300 高斯设备治疗慢性腰痛患者一周,治疗组和对照组的疼痛评分均下降(0.49 vs. 0.44),两组之间无显著性差异[33]。2002 年,30名患者接受了治疗,使用0.1 T设备治疗腕关节疼痛患者约45 分钟时,治疗组与对照组之间没有显著差异[34]。2007年,Kuipers等人发现,暴露0.06 T磁垫1小时不会改变生理应激引起的疼痛感觉[35]。
但是很有意思的是,虽然在文献中只有少数关于稳态磁场对疼痛影响的动物研究,但所有的报道都显示了正面作用。例如,2007年,Laszlo等人表明,稳态磁场能够有效地缓解0.6%醋酸注射引起的小鼠内脏疼痛,且具有治疗时间和磁场强度依赖性[36]。2008 年,Gyires 等人发现,1.6 mT、0.16 T/m 的非均匀稳态磁场暴露30 分钟可显著降低小鼠内脏疼痛水平[37]。Kiss 等人还发现,30 分钟的非均匀稳态磁场治疗可产生比均匀稳态磁场更强的镇痛效果。这些研究都表明治疗时间和磁场强度以及稳态磁场均匀性都是影响稳态磁场镇痛效果的关键因素[38]。此外,也有其他小鼠的疼痛模型显示了积极的镇痛效果。例如2009 年,Antal等人发现,最大强度为476 mT的梯度稳态磁场可以抑制机械刺激引起的小鼠神经痛敏感性增加[39]。2017年,Zhu等人发现,在小鼠牙齿移动模型中,20—204 mT稳态磁场治疗14 天可以显著降低疼痛程度[40]。
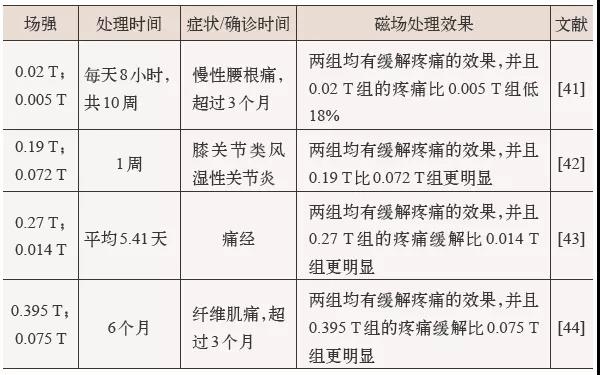
稳态磁场对疼痛缓解的影响与稳态磁场强度、治疗时间和疼痛类型都有关。有一些研究比较了不同的稳态磁场强度,表明高强度的稳态磁场有更好的止痛效果(表1)。因此,我国学者开发了1.5 T 和2.9 T 的超导稳态强磁场设备,目前正在对此进行研究(图2)。此外,疼痛类型是决定稳态磁场是否具有镇痛作用的一个关键因素。例如,前面提到了稳态磁场能显著降低颞下颌关节紊乱病患者的痛觉,但对肺泡炎和口疮没有显著影响。
目前,关于稳态磁场镇痛作用的机制研究非常有限,对其镇痛作用机制的研究尚不明确,在细胞和分子水平上也没有直接的证据,但初步的实验证据显示,辣椒素受体VR1/TRPV1、阿片受体和P2X3 受体等膜受体可能参与其中[37,40,45,46]。这些研究为人们提供了一些潜在的研究方向。此外,正如一些研究者所推测的那样,稳态磁场的镇痛机制可能还与细胞膜本身、离子通道以及促炎/促伤害性神经肽有关,也有可能和上述的血流直接相关,这些都有待进一步研究。
总而言之,通过对实验细节的分析,我们发现稳态磁场缓解疼痛的作用受多个因素的影响,包括稳态磁场强度、治疗时间和疼痛类型等。我们认为,如果使用适当的稳态磁场参数,稳态磁场实际上对管理某些特定类型的疼痛具有相当大的希望。综合评价稳态磁场的参数及其对不同疼痛类型的镇痛作用,以及其潜在的分子机制,将有助于进一步验证其在未来疼痛治疗中的潜力。
04 现状分析与展望
相比其他类型的磁场,稳态磁场无热效应和电效应,并且基于永磁铁的静磁产品使用方便、易穿戴或植入、价格合理等,因此在辅助治疗中具有可行且容易实现等优势。前期的大量实验数据也显示稳态磁场在调节血流、改善骨质和缓解疼痛等方面具有潜在临床应用前景。事实上,除了本文所涉及的这三方面,近年来稳态磁场在代谢、炎症、免疫、肌腱和伤口愈合等方面也显示出了初步良好的应用前景。然而,静磁场在医学治疗领域的应用仍未被人们所广泛接受,至少还未被主流医学所认可,存在着多方面的原因:
(1) 结果不统一。尽管大多数实验研究报道了静磁场对血液调节、骨骼系统以及缓解疼痛具有正效应,但同时也有无效应,甚至有个别报道反效应[47]。导致结果不统一的原因比较复杂,包括磁场参数不同(强度、梯度、分布,甚至磁场方向等)、研究对象不同(正常和不同的疾病状态、不同组织和类型的细胞等),磁场处理方式不同(处理时间和频率等),以及所使用检测方法灵敏度和分辨率等的差异,因此人们还需要更多的实验对产生最佳效果的磁场强度、磁场作用方式以及疾病状态等进行多方面研究。
(2) 研究不规范,缺乏标准化。磁疗的应用不同于药物,因为在不同的研究中,药物可以以相同的量准确地进入人体或细胞,但是磁场相关实验需要考虑多个细节,包括磁体表面与组织的距离、磁体表面磁场强度、磁体材料组成、磁体极性等等。人们以多种不同的方式进行研究,这可能直接影响实验结果。在很多研究中,磁场的参数都没有具体描述,甚至还有些研究没有进行最基本的磁场测量,因此,不同实验得出不同结果也就不足为奇。我们推荐对磁场进行三维空间扫描,从而能够准确地分析受试对象所处的磁场环境。
(3) 机制不清楚。例如,虽然有一些关于稳态磁场镇痛作用机制的研究,但大多基于假设,因此缺乏直接的分子水平的证据。除了磁场对血流的影响有大量的数学和物理方面的研究之外,目前大多数关于磁场生物学效应作用机理的研究多集中在生物学方面,包括蛋白水平的升高与降低和细胞形态、增殖和死亡等基本变化等,然而这些生物学水平的变化可能都不是根本原因,而是引起的中间效应。Muehsam 等人通过体外实验发现稳态磁场可以直接提高人血红蛋白的脱氧率,提示了稳态磁场可能促进生物体内的氧利用率,这可能是磁场导致的多种体内生物学效应的重要机制之一[48]。然而,其具体过程并不清楚。仅从数学和物理机制上分析,例如磁场对血流的影响,往往因其无法考虑生物体系的复杂性,从而不能解释在活体动物和人体上所观测到的现象。因此,人们需要进一步系统性地从物理、化学、生物、医学多个层面,例如磁场对体内电流、自由基、氧化还原、生物样品精确磁性测量、顺磁和抗磁性物质的响应区别、生物体神经调控等多方面进行深入探究。
(4) 人体临床实验不足,且现有的少数临床试验效果不理想。目前的研究多局限于离体细胞及动物模型上,并且动物研究也非常有限。例如,虽然到目前为止所有可用的动物研究都显示了稳态磁场的积极镇痛作用,但它们的研究数量必须进一步扩大,包括更多的疼痛类型。对于人体实验的效果不理想,我们认为这可能是由于磁场参数不正确和治疗时间不足,以及没有区分具体的疾病类型,例如疼痛类型等。人们还应进行大量的研究,以优化稳态磁场的参数和不同的疼痛类型,从而得出稳态磁场对人体镇痛作用的结论。
(5) 安慰剂效应。安慰剂效应在疼痛治疗中非常常见。在8 项磁场效果为“阴性”的研究中,其中6 项研究显示假曝磁组和磁场处理组与未经治疗的对照组相比疼痛均有改善,但假曝磁组和磁场处理组之间没有显著差异。这表明安慰剂效应起着重要作用。事实上,在结果为正效应的多个研究中,安慰剂效应也非常明显。例如,Vallbona 等人的研究中的假曝磁组也有一些安慰剂效应,这使得患者疼痛水平从9.5 分降低到8.4 分,只是磁场处理组的疗效更为明显。此外,76%的磁场处理组患者报告疼痛明显减轻,而安慰剂组只有19%的患者报告疼痛程度减轻。因此,安慰剂效应在磁场对疼痛的影响中不可忽视。但即使如此,还是有超过一半的研究显示了磁场处理组比起安慰剂组来说有着更好的缓解疼痛效果,并且具有统计学意义(图3)。此外,令人感兴趣和惊讶的是,到目前为止,我们所能找到的100%已报道的小鼠研究显示了稳态磁场具有积极的镇痛作用。尽管有限的研究数量、疼痛类型或磁场参数可能都降低了人类研究中阳性结果的百分比,但是我们认为,人类和小鼠的镇痛作用研究的主要区别之一可能是安慰剂效应。事实上,在小鼠研究中缺乏安慰剂效应及其阳性结果在一定程度上证明了稳态磁场在疼痛缓解方面的有效性,至少在已经报道的这些研究中所涉及的磁场参数和疼痛类型方面是如此。对于疼痛等疾病状态来讲,安慰剂的作用可能是强大的,它对人体的巨大影响往往会掩盖某些磁场疗法本身的影响,特别是在目前大多磁场参数还没有优化,因此效果并不是最佳的情况下。因此,需要承认安慰剂效应的存在,承认它对磁场治疗的整体效应的贡献,而不是简单地去否认它。
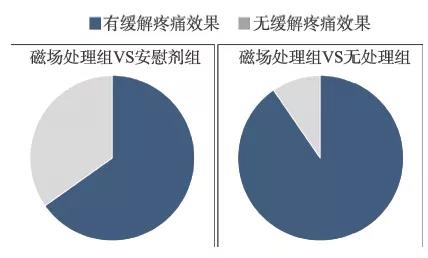
图3 “安慰剂效应”在磁场对人体的疼痛研究中确实存在,但多数研究表明稳态磁场本身相比于“安慰剂”对照组(即Sham control,假曝磁组)来讲效果更强
05 结论
虽然“磁疗”的科学性和有效性一直都存在着争议,也是笔者作为一个受多年传统生物医学教育的科研工作者曾经刻意回避的话题。但随着对磁场生物学效应机制的探索和近年来的研究积累,笔者认为“磁疗”事实上在很大程度上与中医和中药面临着非常类似的困境,即精华与糟粕并存。总体而言,它们的机制复杂并且效果较为温和,无法与西医的立竿见影相比较,但是同时,它们既不是包治百病,也不是伪科学。一方面,由于基于永磁铁的一些磁疗产品可以局部应用于人体特定部位,具有较高的穿透力和时间控制能力,并且通常成本低而安全性良好,因此在世界各国都有一定的人群在使用基于永磁铁的磁疗产品,用来改善一些轻微的疾病或者亚健康状态。近年来有科学实验证据表明稳态磁场在调节血流、改善骨骼系统以及缓解疼痛、影响代谢、减轻炎症以及促进伤口愈合等有着一定的效果。但是另一方面,磁场对人类的具体影响并不完全明确。这不仅是由于从事本领域研究的学者较少,并且对磁场本身或者是生物医学体系也缺乏足够的了解,导致很多研究不够规范化,得到的结果没有很好的可重复性,从机制上也缺乏深入的探索,再加上从业者和商家良莠不齐和夸大宣传等负面影响,都导致了目前所面临的困境。但幸运的是,随着近几年越来越多的专业人员加入本领域,可以借助多学科的现代检测手段、先进理念以及更好的磁场条件,对磁场作用于人体的效应和机制进行系统深入的研究,并针对于不同症状的磁场条件进行优化。例如已经发现,较高场强和较长时间的磁场对缓解疼痛有着更明显的作用,并且笔者课题组近期也发现,不同磁场条件对不同病症有着完全不同的效果。我们相信随着越来越多的学者加入本领域,进行越来越规范化和深入的机制探索和系统研究,磁场疗法一定会在未来被科学地应用于医学领域,在缓解疼痛、改善骨骼和血流等多方面发挥独特的作用。
参考文献
[1] Schuster N M,Rapoport A M. Nat. Rev. Neurol.,2016,12:635
[2] Klein M M et al. Pain,2015,156:1601
[3] Lefaucheur J P et al. Clin. Neurophysiol.,2020,131:474
[4] 磁外科学机遇和挑战(磁外科专辑)。科学通报,2020,65 (13):1163
[5] 张欣,Yarema K,许安. 稳态磁场的生物学效应. 科学出版社,2018.56-57
[6] Basford J R. Arch. Phys. Med. Rehabil.,2001,82:1261
[7] 张欣. 物理,2017,46(7):409
[8] McKay J C et al. Bioelectromagnetics,2007,28:81
[9] Okano H,Ohkubo C. Bioelectromagnetics,2001,22:408
[10] Morris C,Skalak T. Bioelectromagnetics,2005,26:1
[11] Kim S et al. Brain Research,2010,131:211
[12] Alkire M T et al. Science,2008,322:876
[13] Adolphs J et al. Intensive Care Medicine,2004,30:2094-2101.
[14] Ichioka S et al. Medical & Biological Engineering & Computing,1998,36:91
[15] Ichioka S et al. Bioelectromagnetics,2000,21:183
[16] Tzirtzilakis E E. Physics of Fluids,2005,17:077103
[17] Rashidi S et al. Journal of Magnetism and Magnetic Materials,2017,439:358
[18] Okano H,Ohkubo C. Bioelectromagnetics,2007,28:369
[19] Okano H,Ohkubo C. Bioelectromagnetics,2003,24:139
[20] Okano H,Ohkubo C. Bioelectromagnetics,2005,26:469
[21] 杨建成等. 科学通报,2020,65 (13):1238
[22] Xu S et al. Evid.-Based Complement. Altern. Med.,2011,2011:620984
[23] Taniguchi N,Kanai S. Evid.-Based Complement. Altern. Med.,2007,4:99
[24] Zhang H et al. Bone,2018,107:36
[25] Saifzadeh S et al. Iran. J. Vet. Res.,2007,8:8
[26] Rogachefsky R A et al. Bioelectromagnetics,2004,25:260
[27] Taniguchi N et al. Evid.-Based Complement. Altern. Med.,2004,1:187
[28] Morris C E,Skalak T C. Am. J. Physiol. Heart Circ. Physiol.,2008,294:50
[29] Vallbona C et al. Arch. Phys. Med. Rehabil.,1997,78:1200
[30] Kovács-Bálint Z et al. Bioelectromagnetics,2011,32:131
[31] László J F et al. Int. J. Radiat. Biol.,2012,88:430
[32] Caselli MA et al. J. Am. Podiatr. Med. Assoc.,1997,87:11
[33] Collacott E A et al. JAMA-J. Am. Med. Assoc.,2000,283:1322
[34] Carter R et al. J. Fam. Pract.,2002,51:38
[35] Kuipers N T et al. J. Appl. Physiol.,2007,102:1410
[36] Laszlo J et al. Bioelectromagnetics,2007,28:615
[37] Gyires K et al. Bioelectromagnetics,2008,29:456
[38] Kiss B et al. Bioelectromagnetics,2013,34:385
[39] Antal M et al. Bioelectromagnetics,2009,30:438
[40] Zhu Y et al. Bioelectromagnetics,2017,38:22
[41] Khoromi S et al. J. Pain Symptom Manage.,2007,34:434
[42] Segal N A et al. Arch. Phys. Med. Rehabil.,2001,82:1453
[43] Eccles N K. J. Altern. Complement. Med.,2005,11:681
[44] Taylor A et al. J. Altern. Complement. Med.,2001,7:53
[45] Okano H et al. Bioelectromagnetics,2012,33:518
[46] Sandor K et al. Life Sci.,2007,81:97
[47] Harun R et al. Int. J. Environ. Res. Public Health,2015,12:8919
[48] Muehsam D et al. PLoS One,2013,8(4):e61752








